前沿资讯更多 >>
政策解读 | 行业新闻 | 质量信息
 代表委员热议儿童药品短缺 需...
在过去的数十年中,中国儿童药品市场一直承受着来自研发、市场两个方面的制约,发展速度十分缓慢。演变至今,儿童误服药物、服药...
代表委员热议儿童药品短缺 需...
在过去的数十年中,中国儿童药品市场一直承受着来自研发、市场两个方面的制约,发展速度十分缓慢。演变至今,儿童误服药物、服药...
 价格放开对低价药、专利药、稀...
于明德认为,医保目录外血液制品资源非常紧缺,供不应求。此前国家虽然对这类药品制定最高限价,但由于医院进货成本和保存成本高...
价格放开对低价药、专利药、稀...
于明德认为,医保目录外血液制品资源非常紧缺,供不应求。此前国家虽然对这类药品制定最高限价,但由于医院进货成本和保存成本高...
药物研究更多 >>
化药 | 中药 |
 葛兰素史克公布药物研发挑战赛...
葛兰素史克公司的创新挑战赛收到了400多申请,其中14项涉及抗感染、癌症、神经退行性疾病领域的提议脱颖而出。
葛兰素史克公布药物研发挑战赛...
葛兰素史克公司的创新挑战赛收到了400多申请,其中14项涉及抗感染、癌症、神经退行性疾病领域的提议脱颖而出。
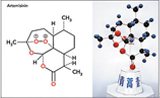 青蒿素能算中药吗?
屠呦呦获得了诺贝尔奖。她在医药领域做出的卓越贡献毋庸置疑。在所有人把关键词集中在:中国、药学家、中药学家、女科学家、85...
青蒿素能算中药吗?
屠呦呦获得了诺贝尔奖。她在医药领域做出的卓越贡献毋庸置疑。在所有人把关键词集中在:中国、药学家、中药学家、女科学家、85...
行业动态更多 >>
市场动态 | 营销快报 |
 新常态下的药品营销新模式
十八大四中全会所传递出的“市场化”新常态信息,也对行业动向有着指导性的影响。因此,不论是商业还是零售,都纷纷向着“新常态...
新常态下的药品营销新模式
十八大四中全会所传递出的“市场化”新常态信息,也对行业动向有着指导性的影响。因此,不论是商业还是零售,都纷纷向着“新常态...
 非医保产品医院销售的六大营销...
搞过药的都知道,医药行业是个非市场经济,受政策的影响巨大,有句话,医药政策像太阳,照到哪里哪里亮,医药政策又像月亮,白天...
非医保产品医院销售的六大营销...
搞过药的都知道,医药行业是个非市场经济,受政策的影响巨大,有句话,医药政策像太阳,照到哪里哪里亮,医药政策又像月亮,白天...
聚焦热点更多 >>
言论 | 视野 |
 原国家卫生部长吐槽医保、药物...
不久前媒体发表一个医改蓝皮书叫《中国医药体制改革报告》,它指出, 2009年—2013年全国财政医疗卫生支出累计是306...
原国家卫生部长吐槽医保、药物...
不久前媒体发表一个医改蓝皮书叫《中国医药体制改革报告》,它指出, 2009年—2013年全国财政医疗卫生支出累计是306...
 移动医疗商业模式盘点
随着云计算、4G 通讯技术进一步成熟,移动互联已经进入并改变着医疗健康领域的各个环节,从日常的健康监测到远程会诊,移动互...
移动医疗商业模式盘点
随着云计算、4G 通讯技术进一步成熟,移动互联已经进入并改变着医疗健康领域的各个环节,从日常的健康监测到远程会诊,移动互...
专家支持
会议汇览更多 >>
行业大会 | 项目论证会 |
 北京恩成康泰受邀参加首届亦庄...
2014年11月20日,首届北京亦庄生物医药产业大会暨2014年北京亦庄生物医药产业创新与发展论坛在北京亦庄生物医药园隆...
北京恩成康泰受邀参加首届亦庄...
2014年11月20日,首届北京亦庄生物医药产业大会暨2014年北京亦庄生物医药产业创新与发展论坛在北京亦庄生物医药园隆...
 中药新药骨科组方项目论证会
中药新药骨科组方项目论证会
中药新药骨科组方项目论证会
中药新药骨科组方项目论证会
临床更多 >>
 临床试验方案设计的6大关键问...
根据有无人为设计的干预措施,把临床研究分为实验性研究和观察性研究,又根据有无随机分组,把实验性研究分为RCT和非RCT,...
临床试验方案设计的6大关键问...
根据有无人为设计的干预措施,把临床研究分为实验性研究和观察性研究,又根据有无随机分组,把实验性研究分为RCT和非RCT,...









 陈可冀
陈可冀 季绍良
季绍良 孙建宁
孙建宁 朱立国
朱立国 陈卫衡
陈卫衡 姜坤
姜坤 杨博华
杨博华 张鹤镛
张鹤镛











